راهنمای طراحی پرایمرهای PCR
7 خرداد 1399اهمیت کیفیت مطلوب RNA تخلیص شده
استخراج RNA با کمیت و کیفیت بالا یکی از نیازهای اساسی مطالعات زیست شناسی مولکولی و اولین گام در بسیاری از تستهای معمول آزمایشگاهی است. تخلیص RNA با کیفیت مطلوب برای بسیاری از کاربردهای پایین دست مانند کلونینگ، رونویسی معکوس برای سنتز cDNA، RT-PCR، RT-qPCR، Northern blotting، cDNA microarray و RNA-seq بسیار مهم میباشد. تخلیص RNAی کل از سلولها، خون، بافتها و نمونههای دیگر میتواند با استفاده از روشهای مختلفی از جمله استفاده از معرفهای گوانیدیم و فنل (Phenole) و به دنبال آن تهنشینی با کلرید لیتیم و اتانول و دانههای مغناطیسی (magnetic beads) انجام شود. از طرف دیگر، کیتهای تجاری جداسازی RNA، حاوی سیستمهای بافری بهینه شده و ستونهای سیلیکا میتوانند مورد استفاده قرار گیرند. صرف نظر از روش مورد استفاده، برای جداسازی و استخراج RNA بصورت موفقیت آمیز، محدود کردن فعالیت ریبونوکلئاز (RNase) با حفظ شرایط دمایی مناسب (۴ درجه سانتیگراد) حیاتی است. همچنین پس از استخراج و تخلیص RNA، کمیت و کیفیت RNA استخراج شده باید مورد بررسی دقیق قرار بگیرد. کیفیت مطلوب RNAی استخراج شده در مقادیر مناسب، تضمین کنندهٔ صحت و دقت کاربردهای آزمایشگاهی پایین دست بعدی است.
۴ پارامتر (معیار) کلیدی که باید بعد از استخراج RNA بررسی شوند.
بطور معمول، چهار پارامتر برای تعیین کمیت و کیفیت RNA استخراج شده مورد مطالعه قرار میگیرد.
۱- غلظت RNAی استخراج شده (نانوگرم در مایکرولیتر)
یکی از روشهای ساده، سریع و مناسب برای اندازه گیری معمولی غلظت RNA، آنالیز اسپکتروفوتومتری (طیف سنجی) نمونههای RNA با استفاده از دستگاه اسپکتروفتومتر مایکرو حجم (micro-volume spectrophotometer یا نانودراپ) است.
البته این دستگاه برای نمونههای رقیق (کمتر از ۲۰ نانوگرم در میکرولیتر) عملکرد خوبی ندارد. همچنین برای اندازهگیری غلظتهای «مطلق» مناسب نیست، زیرا ماکرومولکولهایی نیز ممکن است همراه با RNA استخراج شوند که طیفهای جذبی مشابهی داشته باشند. به عنوان مثال اگر نمونهٔ RNA با DNase تیمار نشده باشد، غلظت خوانش شده میتواند توسط آلودگی DNA متاثر شود. تنها راه برای خوانش دقیق در این موارد، استفاده از روشهای فلوریمتری (Fluorimetric) مانند Qubit است. در یادداشتهای بعدی، این روش مورد بحث قرار خواهد گرفت.
روش اسپکتروفتومتری بر اساس میزان عبور یا جذب نور ماوراء بنفش توسط ماده است. در مورد DNA و RNA، نمونهها در طول موج ۲۶۰ نانومتر (A۲۶۰) در معرض نور ماوراء بنفش قرار میگیرند و نوری که از داخل نمونه عبور میکند توسط یک دستگاه گیرنده (ردیاب) اندازهگیری میشود. مقداری از نور ماوراء بنفش، عبور کرده و مقداری توسط DNA / RNA جذب میشود. هر چه جذب نوری توسط نمونه بیشتر باشد، یعنی غلظت اسید نوکلئیک در نمونه بیشتر است. بنابراین نورِ کمتر ثبت شده توسط دستگاه ردیاب، چگالی نوری (Optical Density; OD) بالاتری را تولید میکند.
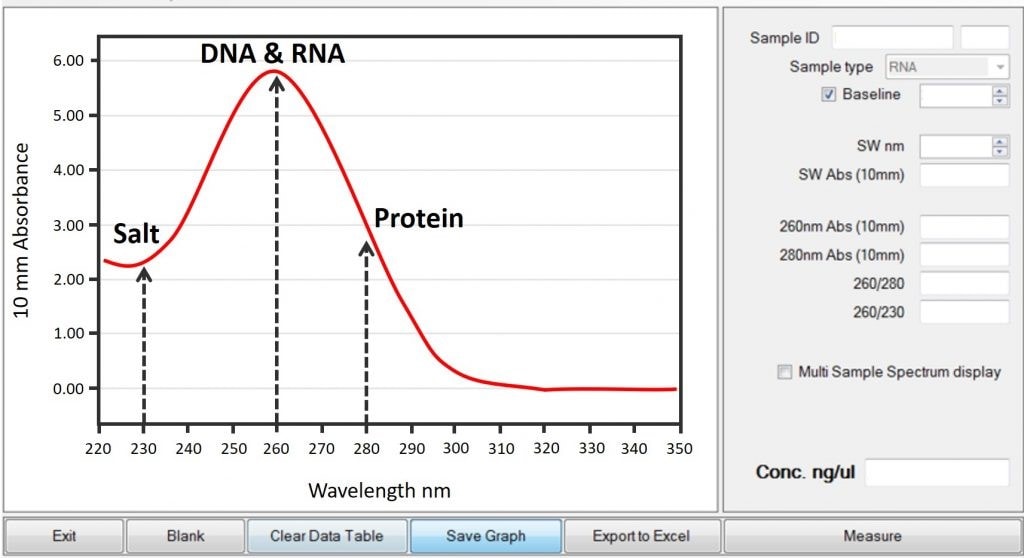
جذب نوری ۲۶۰، ۲۳۰ و ۲۸۰ در متن توضیح داده شده است.
۲- خلوص RNA یا RNA purity
اسپکتروفتومتر قادر است علاوه بر تعیین میانگین غلظت اسیدهای نوکلئیک DNA یا RNA موجود در مخلوط، خلوص آنها را نیز تعیین کند. خلوص نمونه های RNA استخراج شده، با بررسی نسبتهای OD بدست آمده در طیف سنجی معمولی به سرعت قابل ارزیابی است.
در RNA خالص، نسبت جذب نوری ۲۶۰ نانومتر به ۲۸۰ نانومتر (260/280 ratio) حدود ۱.۹ – ۲.۰ است.
- مقدار پایین تر نشان دهنده آلایندههای پروتئینی است. آلودگی پروتئین میتواند بسیاری از فرایندهای پایین دست بعدی، مانند reverse transcription و qPCR را متاثر کند.
- برای بهبود نسبتهای ۲۶۰ به ۲۸۰، بهترین راه حذف آلودگی پروتئینی است. برای این منظور استفاده بیشتر از آنزیم پروتئیناز K (یا proteinase K) و انکوباسیون در طول شب میتواند موثر باشد.
در RNA خالص، نسبت جذب ۲۶۰ نانومتر به ۲۳۰ نانومتر (260/230 ratio)، حدود ۲.۰ -۲.۲ است.
- مقدار پایینتر نشان دهنده وجود نمک و سایر آلایندهها مانند فنول، EDTA، گوانیدین هیدروکلراید (guanidine hydrochloride) در RNA استخراج شده است. فنولی که در اغلب بافرهای استخراج وجود دارد، دارای اثر مهاری روی اکثر پلیمرازها است. بنابراین آلودگی فنلی (و سایر ترکیبات فنولیک) میتواند روی روی کاربردهای پایین دست بعدی اثر منفی داشته باشد.
- برای بهبود نسبت های ۲۶۰ به ۲۸۰، میتوان با استفاده از ستون (spin-column) نمونهها را مجددا تمیز کرد و یا دوباره آنها را رسوب داد. افزودن مراحل شستشوی بیشتر در طی این فرایندها میتواند به از بین بردن آلودگیها کمک کند. اگرچه انجام این کار همچنین میتواند منجر به از دست دادن مقداری اسید نوکلئیک نیز شود. اما از دست دادن مقدار کمی از نمونه برای رسیدن به نمونههای خالص ارزش دارد.
۳- باندهای RNA ریبوزومی
از آن جاییکه RNAهای ریبوزومی (rRNAs)، ۷۰ درصد RNAی کل سلول را تشکیل میدهند، بنابراین مشاهدهی باندهای RNAهای ربیوزومی، بصورت شارپ و واضح روی ژل آگارز، میتواند نشانگر یک استخراج با کیفیت مطلوب باشد. در حالیکه وجود باندهای تخریب شده برای RNAهای ریبوزومی، حاکی از تخریب احتمالی سایر RNAهای سلول و کیفیت پایین تخلیص است.
RNAهای ریبوزومی به دست آمده از سلولهای مختلف، دارای اندازههای متفاوتی هستند که در جدول ذیل مشخص شده است.
| Bacteria | Yeast | Mouse | Human | Plant |
|---|---|---|---|---|
|
rRNA
Size (Kb)
|
rRNA
Size (Kb)
|
rRNA
Size (Kb)
|
rRNA
Size (Kb)
|
rRNA
Size (Kb)
|
|
16S
1.5
|
18S
Size (Kb)
|
18S
1.9
|
18S
Size (Kb)
|
8S
1.9
|
|
23S
2.9
|
26S
Size (Kb)
|
28S
4.7
|
28S
Size (Kb)
|
25S
3.7
|
|
16S
1.5
|
||||
|
23S
d2.9
|
در RNA خوب به دست آمده از نمونه های یوکاریوتی، بایستی شدت باند 28S به باند 18S، به نسبت ۲ به ۱ باشد. در RNA خوب به دست آمده از نمونه های پروکاریوتی، بایستی شدت باند 23S به باند 16S، به نسبت ۲ به ۱ باشد.
۴- یکپارچگی RNA یا RNA integrity
به دلیل حضورِ فراگیر RNaseها در محیط، RNA بسیار مستعد تخریبشدن است. بنابراین بررسی یکپارچگی RNA یکی دیگر از معیارهای مهمِ آنالیز RNAی استخراج شده است که با استفاده از الکتروفورز ژل آگارز (۱٪) قابل ارزیابی است. با مقایسهی ضخامت و شدت (شارپی) باندهای بدست آمده روی ژل، می توان به کیفیت RNAی استخراج شده پی برد. شکستگی قطعههای RNA در طی استخراج که به صورت اسمیر روی ژل دیده میشود، به عنوان معیاری برای کیفیت پایینتر نمونههای استخراج شده است. همچنین آلودگی RNAی استخراج شده به DNAی ژنومیک، بصورت یک باند مجزا در نزدیکی چاهک روی ژل قابل رویت است. برای حفظ یکپارچگی RNA تخلیص شده، از فریز کردن و ذوب کردن متناوب آن پرهیز کنید. بمنظور جلوگیری از فریز و ذوب شدن مکرر نمونهی RNAی تخلیص شده، بهتر است پس از استخراج، نمونهی RNA به دست آمده در حجمهای کمتری تقسیم یا الیکوات (Aliquot)، و در فریزر ۸۰- نگهداری شود بطوریکه برای هر بار استفاده فقط یکی از حجمهای تقسیم شده استفاده گردد. روش های دیگری نیز برای بررسی یکپارچگی RNA وجود دارند که در یادداشتهای بعدی به آنها میپردازیم.
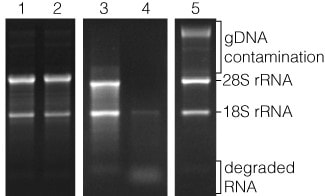
بررسی کیفیت RNA توسط الکتروفورز ژل آگارز.
باندهای 28S و 18S در نمونه ی RNAی یوکاریوتی مشخص شده است.
چاهکهای ۱ و ۲: نمونه هایی از RNA ی سالم با نسبت شدت باند 28S به 18S، تقریباً ۲ به ۱ هستند.
چاهک ۳: نمونهای از RNA تخریب شده با اسمیری از RNA در زیر باندهای 28S و 18S میباشد.
چاهک ۴: نمونهای از تخریب RNA و در نتیجه از بین رفتن باند 28S و تجمع RNA تخریب شده در نزدیکی پایین ژل است.
چاهک ۵: نمونهای از RNA، با آلودگی قابل ملاحظه به DNA ژنومی (gDNA) است.
نتیجهگیری
در این پست از بلاگ دنازیست، در رابطه با اهمیت و روشهای اندازهگیریِ کمی و بررسیِ کیفی RNA استخراج شده از نمونههای مختلف صحبت کردیم. با توجه به اهمیت کمیت و کیفیت مطلوب RNAی تخلیص شده و تاثیر آن بر روی کاربردهای پایین دست بعدی، انتخاب روش و کیت استخراج RNA مناسب بسیار مهم و حیاتی است. روشهای دستی قدیمی و کیتهای تجاری مختلفی برای این منظور مورد استفاده قرار میگیرند.
تجربه شما در رابطه با استخراج RNA چیست؟ لطفا تجارب ارزشمند خود را در قسمت «دیدگاهها» با ما و سایرین به اشتراک بگذارید.
اگر در رابطه با فرایند استخراج و جداسازی RNA سوال یا ابهامی دارید؛ در قسمت «دیدگاهها» بنویسید، محققین بخش «تحقیق و توسعه» دنازیست در کنار شما هستند.
منابع
Guidelines for RNA Quantitation | NEB
RNA quantification and analysis | QIAGEN
Assessment of Nucleic Acid Purity | Thermo Fisher Scientific
Image Sources: Main Pic | Nanodrop Result | Gel Result






18 Comments
مطالعه کردم جامع و کامل بود اگر یک بار مطالعه بفرمایید دو سه نکته اشتباه یا تکراری نوشته شده اصلاح بفرمایید
سپاسگزارم
با سلام خدمت شما.
ممنون میشیم عباراتی که اشتباه یا تکراری هستند رو به ما بگید تا تصحیحش کنیم.
ضمنا از اینکه نظر خودتون رو با ما به اشتراک گذاشتید متشکریم.
در RNA خالص، نسبت جذب ۲۶۰ نانومتر به 230 نانومتر (260/230 ratio)، حدود ۲.۰ -۲.۲ است
ممنون از دقت و نظر شما. غلط املایی اصلاح شد.
متشکریم
در RNA خالص، نسبت جذب نوری ۲۶۰ نانومتر به ۲۸۰ نانومتر (260/280 ratio) حدود ۱.۹ – ۲.۰ است.
در RNA خالص، نسبت جذب ۲۶۰ نانومتر به ۲۸۰ نانومتر (260/230 ratio)، حدود ۲.۰ -۲.۲ است.
این دو مطلب کدومش درست هست ؟
ممنون از دقت شما.
در خط دوم، عبارت صحیح به این شکل است:
در RNA خالص، نسبت جذب ۲۶۰ نانومتر به ۲۳۰ نانومتر (260/230 ratio)، حدود ۲.۰ -۲.۲ است.
سلام و خداقوت!
در جدولی که اندازه باندهای rRNA را ذکر کردید، برای گیاه چهار اندازه باند است. یعنی در زمان استخراج RNA از گیاه چهار باند بر روی ژل دیده می شود؟
سلام خدمت شما.
بله، تا ۴ باند برای بخشهای مختلف گیاه قابل رویت است.
سلام، وقت مقدار حجمی که از نمونه rnaیا dna که به دستکاه میدهیم تا غلظت را محاسبه کند چقدر هست؟
سلام،
میزان حجم نمونه بسته به دستگاه مورد استفاده شما و حتی تنظیمات دستگاه متفاوت است.
برای اطلاع دقیق از میزان حجم مورد نیاز برای اندازه گیری میزان RNA استخراج شده، لطفا بروشور دستگاه مورد نظر خود را چک بفرمایید.
با سلام و تشکر
آیا پس از استخراج RNA و نگهداری آن در دمای منهای 20 و دو مرحله ذوب RNA استخراج شده امکان از بین رفتن آن است؟
تجربه داشتم پس از ذوب دوباره RNA استخراج شده نتیجه مثبت یک بیماری در فرایند Real time PCR به منفی تغییر پیدا کرده است آیا این ذوب و نگهداری نامناسب تاثیر داشته است؟
با سلام؛
دما مهمترین عامل در پایداری RNA در طول ذخیره سازی است:
برای بهترین پایداری و برای نگهداری طولانی مدت، RNA باید در دمای ۷۰- درجه سانتیگراد نگهداری شود. برای ذخیرهسازی کوتاهمدت، RNA در دمای ۲۰- درجه سانتیگراد برای حداقل ۳ هفته پایدار است.
سلام و خداقوت استفاده کردم متشکرم.
سلام.
خوشحالیم که از این مطلب آموزشی استفاده کردید. و ممنون بابت اینکه بازخورد خودتون رو با ما به اشتراک گذاشتید.
سلام وقتتون بخیر. ممنونم از مطالب خوبتون.
ببخشید الان برای مطالعهای که ۹۰ تا نمونهی خون داره و باید استخراج rna از خون انجام بشه، از کدوم کیت rna باید استفاده بشه و چند تا کیت مورد نیازه؟
و اینکه غلظت rna نهایی بعد از استخراج از خون با کیت استخراج، از ابتدا مشخص هست؟
اینکه با استفاده از کیت، با چه غلظتی rna خواهیم داشت؟
برای هر نمونه به چند cc خون نیازه؟
ممنون میشم از شما بابت پاسخگوییتون🙏🏻
سلام
۱— ۹۰ تا نمونه باید ۱۸۰ نمونه در نظر گرفته شود. یعنی تقریبا ۲۰۰ واکنش (به دلیل شرایط نمونه، احتمال تکرار و خطای کاربر). یعنی چهار کیت ۵۰ واکنشی.
(البته میتوانید یک کیت تهیه کرده و در صورت رضایت از نتیجه، همچنین بهینهسازی شرایط استخراج، با توجه به میانگین تعداد واکنش مصرف شده برای هر نمونه، کیتهای بعدی را سفارش دهید)
۲— کیت استخراج RNA از خون به شماره کاتالوگ s-1021-1 باید استفاده شود.
۳— غلظت RNA استخراج شده نمونه به نمونه ممکن است متفاوت باشد و این بستگی به میزان سلول در واحد حجم خواهد داشت. یعنی ممکنه در ۱ میلی لیتر ۱۰۰۰ عدد سلول باشد یا ۱۰۰۰۰ عدد یا … . به طور کلی غلظت بین ۱۰۰ تا ۴۰۰ نانوگرم خواهد بود که برای انجام پروسه های بعدی نظیر RT-PCR و real-time PCR کافی است. به دلیل اینکه روش ستونی است خلوص RNA بالا خواهد بود.
۴— برای هر نمونه حداقل ۲ میلی لیتر خون تازه یا نگهداری شده در منفی ۸۰ کافی است. ضمنا جهت ارسال نمونهها از محل اخذ نمونه تا آزمایشگاه بهتر است از تانک ازت پرتابل (قابل حمل) استفاده شود.
با آرزوی موفقیت برای پژوهش شما.
سلام ، آیا از این کیت برای استخراج RNA بافت پوست موش می توان استفاده کرد؟ممنون
سلام. بله.