
کشت سلول: چالش pH، دما و CO2
24 اردیبهشت 1399
مقدمهای بر انتقال ژن (ترانسفکشن) – بخش دوم
30 شهریور 1399در این مقاله، که در ۳ بخش ارائه میگردد در خصوص انتقال ژن توسط روشهای غیر ویروسی به سلولهای یوکاریوتی بحث خواهد شد. این ۳ بخش به ترتیب به صورت زیر خواهند بود:
- انتقال ژن توسط روشهای غیر ویروسی به سلولهای یوکاریوتی (بخش ۱) – مقدمه ای بر انتقال ژن (ترانسفکشن)؛
- انتقال ژن توسط روشهای غیر ویروسی به سلولهای یوکاریوتی (بخش ۲) – ملاحظات عمومیدر ترانسفکشن؛
- انتقال ژن توسط روشهای غیر ویروسی به سلولهای یوکاریوتی (بخش ۳) – نکاتی در مورد نحوه اجرای پروتکل های ترانسفکشن.
بخش ۱- مقدمه ای بر انتقال ژن (ترانسفکشن)
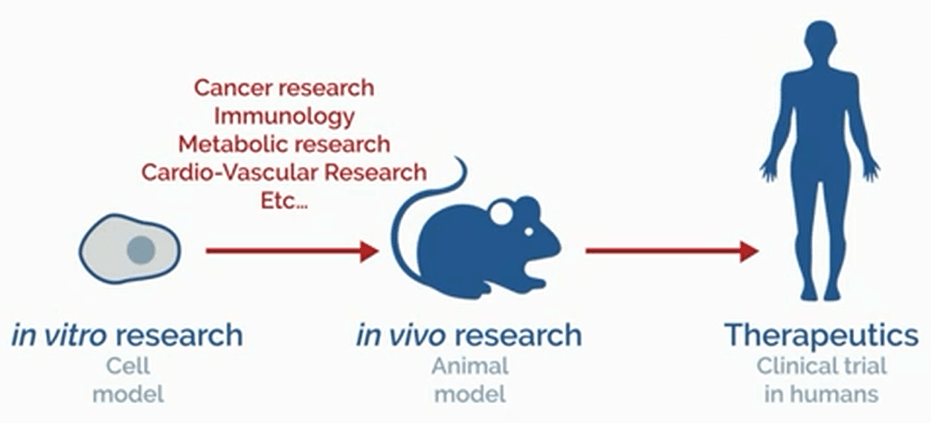
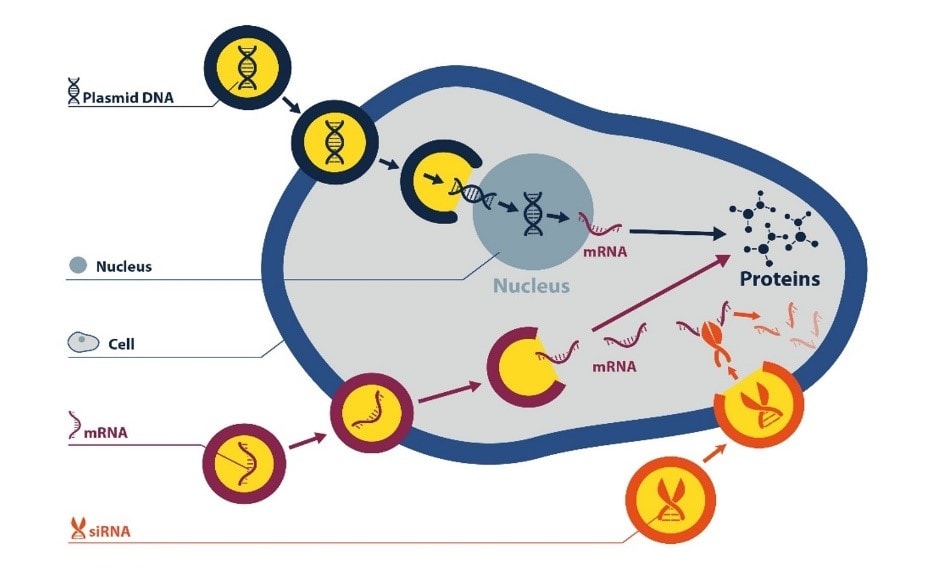
ترانسفکشن فرآیندی است که توسط آن اسیدهای نوکلئیک نظیر DNA یا RNA و یا الیگونوکلئوتیدها به سلولهای یوکاریوتی با روشهایی غیر ویروسی ارائه میشوند. با استفاده از روشهای انتقال فیزیکی و شیمیایی ژن، امکان مطالعه عملکرد ژن و بیان پروتئین در محیط سلولی مهیا شده است. با توسعه سیستمهای ژنی گزارشگر (Reporter genes) و روشهای انتخابگر برای حفظ پایداری و بیان DNA انتقال داده شده، کاربردهای انتقال ژن بسیار توسعه پیدا کرده است. اسیدهای نوکلئیک میتوانند توسط مواد ترانسفکشن پلیمری یا لیپیدی که جذب سلولی را تسهیل میکنند انتقال داده شوند. فرآیند ترانسفکشن بطور معمول بمنظور مطالعات ژنومیک در محیط آزمایشگاهی (in vitro research) نظیر بیان ژن، غربالگری و RNA مداخلهگر (RNA interference – RNAi)، انجام تحقیقات در محیط زنده (in vivo research)، بمنظور تولید محصولات زیستی نظیر ویروس و پروتئین، و یا اهداف درمانی (therapeutics) نظیر ژن درمانی مورد استفاده قرار میگیرند (شکل ۱).
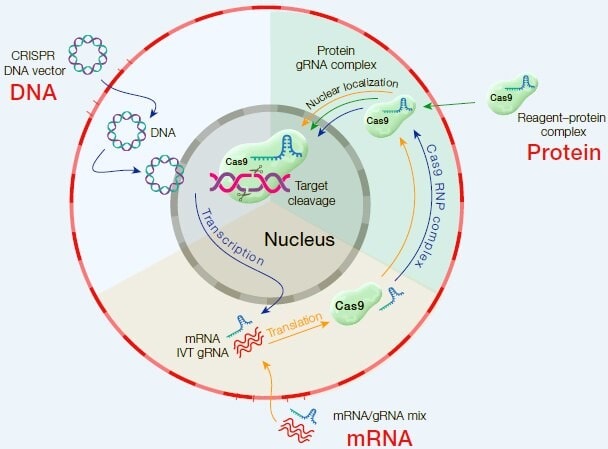
انتقال اسیدهای نوکلئیک و پروتئینها به داخل سلولها میتواند توسط روشهای فیزیکی نظیر الکتروپوریشین، سونوپوریشن یا میکرواینجکشن انجام شود، اما این فرآیند ها تا حدودی برای سلولها سمی هستند. ترانسفکشن با ترکیبات شیمیایی میتواند جایگزین مناسب و ایمنی برای انتقال اسیدهای نوکلئیک و پروتئینها به داخل سلول و حفظ سلامت سلول هدف باشد (شکل ۲).
مکانیسم ترانسفکشن با ترکیبات شیمیایی
ورود اسیدهای نوکلئیک به داخل سلولها شامل ۳ مرحله است که در ادامه به هریک از آنها میپردازیم.
۱- میانکنش کمپلکس ترانسفکشن با غشا سلول و ورود به داخل سلول (Complexation and entry)
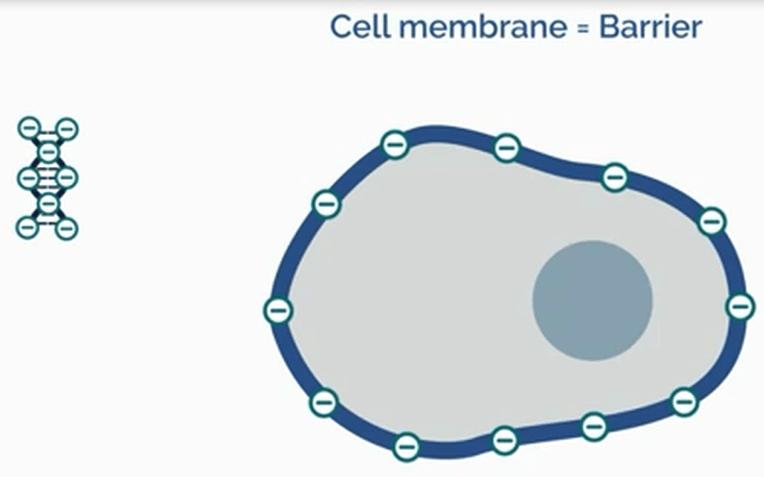
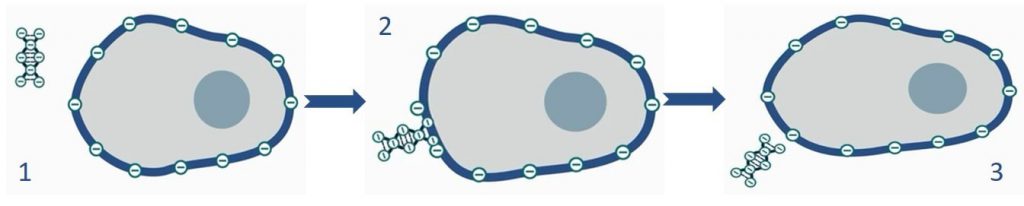
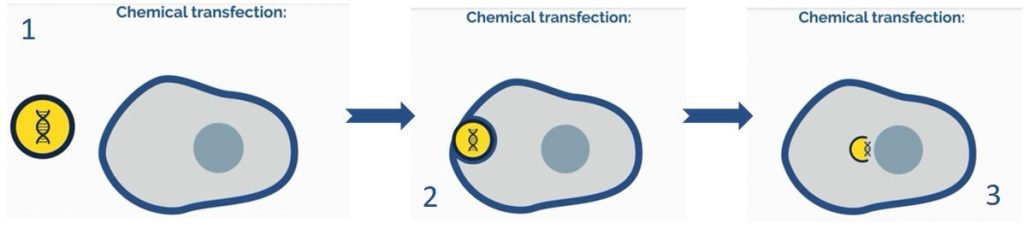
چالش اصلی در ترانسفکشن با ترکیبات شیمیایی ارائه مولکول هایی با بار منفی نظیر اسیدهای نوکلئیک (که ناشی از وجود گروههای فسفات در بدنه آنها میباشد) به سلولهای حاوی غشای با بار منفی است (شکل ۳ و ۴). مواد شیمیایی نظیر کلسیم فسفات و دی اتیل آمینو اتیل دکستران (DEAE-dextran) یا ترکیباتی بر پایه کاتیونی توانایی احاطه نمودن DNA، خنثی کردن یا حتی تحمیل بار مثبت به مولکول مورد نظر را دارند. ترکیب ماده ترانسفکشن با یک اسیدنوکلئیک مشخص را «کمپلکس ترانسفکشن» مینامند که علاوه بر حفاظت از اسید نوکلئیک در برابر تخریب نوکلئازی، منجر به تسهیل عبور کمپلکس ترانسفکشن از غشا میشود. به دلیل اینکه لیپیدها یک ترکیب فیوزوژنیک (fusogenic) با قدرت اتصال بالا به غشای دو لایه لیپیدی سلول هستند عبور آنها از غشای اغلب سلولها با سهولت انجام میشود.
سلولهای چسبنده توانایی بیان پروتئوگلیکان های هپاران با شارژ منفی بر روی سطح غشا خود را دارند طوریکه ترکیبات شیمیایی طراحی شده برای ترانسفکشن که حاوی بار مثبت میباشند توانایی اتصال به آن را دارند. این میانکنش، منجر به آغاز جذب سلولی توسط فرآیند اندوسیتوز میشود.
سلولهای سوسپانسیونی در مقایسه با سلولهای چسبنده، توانایی کمی در بیان پروتئوگلیکان های هپاران با شارژ منفی بر روی سطح غشا خود را دارند. بنابراین به دلیل میانکنش های کمتر با کمپلکس ترانسفکشن، ترانسفکشن آن ها دشوار است. نسل جدیدی از ترکیبات ترانسفکشن وجود دارند که بر این محدودیت غلبه کرده و ترانسفکشن قابل قبولی را در اکثر سلولهای سوسپانسیونی «سخت-ترانسفکت (Hard to transfect)» رقم میزنند.
۲- آزاد شدن اسید نوکلئیک در سیتوپلاسم
به محض ورود کمپلکس ترانسفکشن به داخل سلول، این کمپلکس در وزیکول های اندوسیتوزی داخل سلولی بسته بندی میشوند. کارآمدترین ترکیبات ترانسفکشن، توانایی القا آزادسازی اسیدهای نوکلئیک به سیتوپلاسم با ایجاد اتصال یا گسیختگی در غشا وزیکول های اندوسیتوزی را دارند.
۳- انتقال به هسته (اگر قصد بیان ژن است)
اکثر اسیدهای نوکلئیک نظیر اولیگونوکلئوتیدها، siRNA، mRNA و … در سیتوپلاسم یعنی جائیکه فعال میباشند باقی میمانند. اما DNA پلاسمیدی وارد هسته میشود تا بطور گذرا یا دائمی (در صورت الحاق در ژنوم) در هسته بیان داشته باشد (شکل ۶).
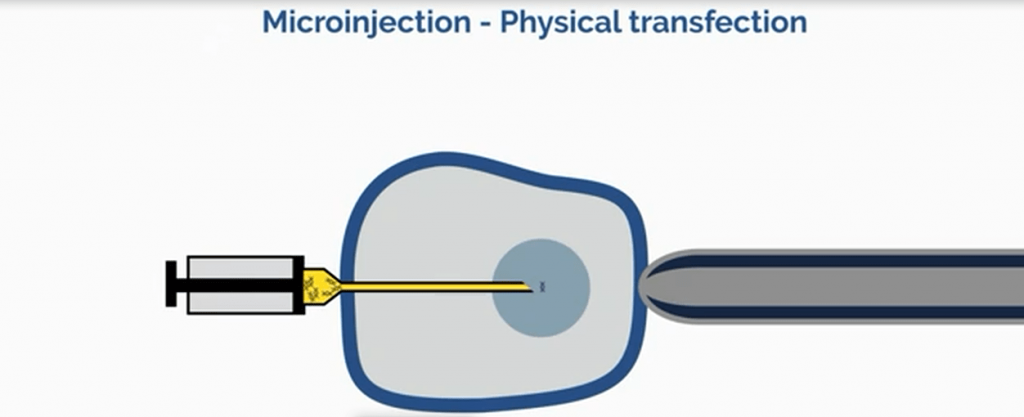
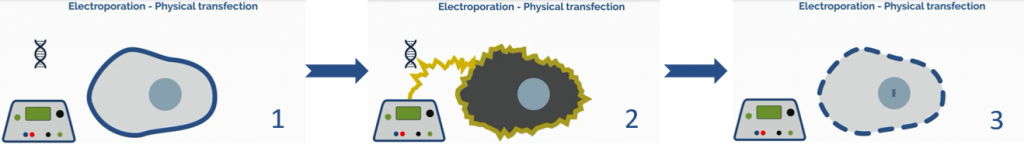
علاوه بر روشهای شیمیایی، روشهای فیزیکی نظیر میکرواینجکشن (شکل ۷) یا الکتروپوریشن (شکل ۸) با ایجاد روزنه در غشا سلول امکان ارائه ی مستقیم DNA به سیتوپلاسم را فراهم میآورد. هر یک از این تکنولوژی های ترانسفکشن (شیمیایی و فیزیکی) در بخش های بعدی به تفصیل مورد بحث واقع خواهد شد.
۱- ترکیبات شیمیایی
پلیمر کاتیونی DEAE-dextran، یکی از اولین ترکیبات شیمایی استفاده شده بمنظور ترانسفکت سلولهای پستانداری کشت داده شده بود. بار مثبت مازادی که توسط پلیمر در کمپلکس ترانسفکشن اعمال میشود، امکان اتصال کمپلکس به غشای سلول را فراهم میسازد. جذب کمپلکس احتمالا با اندوسیتوز خواهد بود. این روش بطور موفقیت آمیز اسیدهای نوکلئیک را جهت بیان گذرا انتقال میدهد که برای مطالعات بیانی کوتاه مدت استفاده میشود.
با این وجود و بطور کلی DEAE-dextran برای مطالعات بیانی بلند مدت و پایدار که بر مبنای الحاق DNA در ژنوم موجود هدف است مناسب نمیباشد. دیگر پلیمرهای سنتتیک کاتیونی نظیر پلی برن، پلی اتیلن ایمین و دندریمرها برای انتقال DNA به سلولها استفاده میشوند.
رسوب دهی همزمان با کلسیم فسفات (CaP) به عنوان روش ترانسفکشن در اوایل سال ۱۹۷۰ معرفی گردید. این روش هنوز هم مورد توجه است چراکه مواد آن به راحتی قابل دسترس بوده و ارزان میباشد، پروتکل اجرایی آن آسان است، و با انواع سلولهای کشت یافته سازگار میباشد. در این روش DNA با کلسیم کلراید (CaCl2) مخلوط شده و در دمای اتاق انکوبه میشود. سپس این کمپلکس توسط سلولها و با فرآیند اندوسیتوز یا فاگوسیتوز برداشت میشود. این روش بطور معمول برای انتقال پایدار یا گذرای ژن به انواع مختلفی از سلولها بکار میرود.
با این وجود، این کمپلکس برای انتقال ژن به صورت in vivo به جانداران مناسب نیست. همچنین، تغییرات کوچک pH (± 0.1) میتواند کارآیی ترانسفکشن را تحت تاثیر قرار دهد. به دلیل محدودیت های DEAE-dextran و کلسیم فسفات، ترکیبات شیمیایی سنتتیک بر پایه لیپید معرفی شدند.
۲- لیپیدهای کاتیونی
واژه «لیپوزوم» اشاره به دو لایه لیپیدی دارد که ذرات کلوئیدی را در محیط آبی تشکیل میدهد. لیپوزومهای مصنوعی برای اولین بار در سال ۱۹۸۰ بمنظور انتقال ژن استفاده شدند. گام بعدی در استفاده از این ابزارها، توسعه لیپیدهای کاتیونی سنتتیک در سال ۱۹۸۷ بود. سر کاتیونی ترکیبات لیپیدی به فسفاتهای شارژ منفی در اسید نوکلئیک متصل میشوند. انتقال برپایه لیپوزوم، مزایایی نظیر «کارآیی نسبتا بالا در انتقال ژن»، «توانایی ترانسفکت انواع سلولهای اختصاصی که مقاوم به ترانسفکت با کلسیم فسفات یا DEAE-dextran هستند»، «کاربردهای in vitro و in vivo»، «انتقال موفقیت آمیز DNA با سایزهای متفاوت (فرمهای الیگونوکلئوتیدی کوتاه تا کروموزومهای بزرگ مخمری)»، «انتقال RNA و پروتئین» را دارند.
سلولهای ترانسفکت شده با روشهای لیپوزومی میتوانند بمنظور مطالعات بیانیِ گذرا و حتی طولانی مدت که بر اساس الحاق DNA در کروموزوم است مورد استفاده قرار گیرند. برخلاف روشهای شیمیایی DEAE-dextran یا کلسیم فسفات، انتقال اسید نوکلوئیک بر پایه لیپوزومی میتواند برای انتقال DNA و RNA به حیوانات و انسان استفاده شود. یک لیپید با بار خالص مثبت در pH فیزیولوژیک مهمترین جزء در توسعه و بهره برداری از روشهای انتقال ژن خواهد بود. اغلب، لیپید کاتیونی با لیپیدی خنثی نظیر L‑dioleoyl phosphatidylethanolamine (DOPE) میتواند منجر به افزایش توانایی انتقال ژن شود.
بخش کاتیونی مولکول لیپید به اسیدهای نوکلئیک شارژ منفی متصل شده و منجر به بسته بندی اسید نوکلئیک و ایجاد کمپلکس ترانسفکشن میشود. سلولهای کشت یافته با غشای حاوی بار منفی، با کارآیی بسیار بالا به این کمپلکس که حاوی شارژ مثبت خالص میباشد متصل میشوند. انتقال این کمپلکس به داخل سلول توسط اندوسیتوز یا اتصال با غشای پلاسمایی توسط بخش های لیپیدی لیپوزوم خواهد بود. بعد از ورود به سلول، این کمپلکس ها در ساختارهای اندوزومی به سمت هسته هدایت میشوند. مشخص نیست که چگونه این کمپلکس ها از اندوزوم ها رها شده و از غشا هسته عبور میکنند. DOPE یک لیپید فیوزوژنیک است و نقش احتمالی آن رهاسازی این کمپلکس ها از اندوزومها و نیز تسهیل اتصال غشا خارجی سلول با این کمپلکس میباشد.
۳- ترکیبات غیرلیپوزومی
اگرچه ترکیبات لیپوزومی طیف وسیعی از کاربردها را دارند، ممکن است در تمامی ردههای سلولی کارآمد عمل نکنند. در این حالت ترکیبات غیرلیپوزومی روشی جایگزین محسوب میشود. این ترکیبات شامل پلیمرهایی هستند که توانایی تشکیل کمپلکس با DNA یا RNA و سایر لیپیدهایی که میتوانند در محلول های آبی میسل تشکیل بدهند را دارند. استفاده از نانوذرات لیپیدی فرم پیشرفته ای از این روشها را به وجود میآورد که برای انتقال داروهای مولکولی کوچک در تحقیقات بالینی و کاربردهای درمانی بسیار مورد توجه واقع شده است.
از ترکیبات غیرلیپوزومی میتوان به ماده ترانسفکت FuGENE® HD که مناسب انواع سلولهای سخت-ترانسفکت است و نیز FuGENE® 6 که مناسب انواع مختلفی از ردههای سلولی میباشد اشاره کرد که هر دو با کارآیی بالا و سمیت پائین انتقال ژن را انجام میدهند. شما باید بهترین ماده و شرایط ترانسفکت را برای سلول اختصاصی مورد نظرتان بطور تجربی بدست آورید، چراکه به دلیل خصوصیات ذاتی برخی سلولها، عمل ترانسفکشن با عدم موفقیت همراه خواهد بود.
۴- روشهای فیزیکی
روشهای فیزیکی انتقال ژن در اوایل سال ۱۹۸۰ مطرح شد. میکرواینجکشن مستقیم به سلولهای کشت یافته یا هسته یک روش کارآمد و البته نیازمند به مهارت است. این روش بطور گسترده برای انتقال DNA خارجی به اووسیتهای زنوپوس و جنینهای دروزوفیلا استفاده میشد. اگرچه خیلی کارآمد نبود ولی هنوز هم برای انتقال ژن به سلولهای بنیادی به منظور تولید ارگانیسم های تراریخته استفاده میشود، بویژه برای تحقیقات در حیوانات مزرعه. اخیرا این روش مورد توجه کاربردهای ویرایش ژنوم نیز قرار گرفته است. برای مثال، از این روش بمنظور انتقال DNAی مربوط به CRISPR-Cas9 به داخل پیش هسته زیگوت جهت تولید خوک های ناک آوت استفاده شده است.
یکی دیگر از روشهای فیزیکی انتقال ژن الکتروپوریشین است که برای اولین بار جهت انتقال ژن در سلولهای موشی در سال ۱۹۸۲ مورد استفاده واقع گردید. مکانیسم آن بر پایه استفاده از پالس الکتریکی بمنظور ایجاد روزنه های ریز در غشا سلول جهت عبور اسیدهای نوکلئیک به داخل سلول است. این روش نیازمند بهینه سازی در خصوص مدت زمان پالس و قدرت پالس میباشد که بسته به نوع سلول متفاوت خواهد بود. این روش اغلب نیازمند سلولهای بیشتری نسبت به روشهای شیمیایی است چراکه منجر به مرگ قابل توجه سلولها میشود و به بهینه سازی گسترده ای برای بالانس کارآیی ترانسفکشن با مانایی سلول نیاز دارد.
ابزارهای جدید این امکان را فراهم کردهاند تا اسید نوکلئیک به سلولهای اولیه و سلولهای بنیادی انتقال یابند. این روش در ترکیب با ابزارهایی نظیر میکروفلوئیدیک که منجر به انقباض فیزیکی سلولها میشود نیز بکار رفته است تا بیان ژنی سریع در یک فرمت با توان بالا رخ دهد. دستگاه میکروفلوئیدیک ابزاری است که با آن میتوان با اعمال فشار مکانیکی به غشا سلول، تغییر شکل در غشا ایجاد کرد و سپس با اعمال جریان الکتریکی تخریب قابل بازگشت در غشای سیتوپلاسم و هسته ایجاد کرد و در نهایت DNA با شارژ منفی را به درون سیتوپلاسم یا هسته هدایت کرد.
یکی دیگر از روشهای فیزیکی انتقال ژن استفاده از ذرات بیولیستیک (biolistic) میباشد که بدان بمباران ذرات نیز میگویند. این روش بر مبنای انتقال اسیدهای نوکلوئیک توسط میکروپروجکتایل ها با سرعت انتقال بالا به سلولهای گیرنده از طریق نفوذ به غشا میباشد. این روش جهت انتقال اسیدهای نوکلئیک به سلولهای کشت یافته در محیط آزمایشگاهی و نیز به سلولها در محیط زنده استفاده میشود. هزینه بالای دستگاه بمباران ذرات، استفاده از آن را در کارهای تحقیقاتی محدود کرده است. این روش ابتدا در تحقیقات ژنتیک گیاهی مورد استفاده قرار گرفته است. با این وجود، پیشرفت های اخیر در تکنولوژی نانوذرات، چشم اندازهای جدیدی در استفاده از این روش ایجاد کرده است.
نانوذرات مواد سنتتیکی هستند که کمتر از ۱۰۰ نانومتر میباشد. به دلیل سایز کوچک، نانوذرات توانایی عبور از غشاهای سلولی با کارآیی بالا را دارند و آنها میتوانند از طریق میانکنش های کووالانسی و غیر کووالانسی با DNA و RNA از غشا عبور کنند. این خصوصیات منجر به استفاده از این روش بمنظور تولید حیوانات تراریخته شده است و جایگزین میکرواینجکشن به پیش هسته یا وکتورهای ویروسی شده است. نوع دیگری از این روش از نانوذرات اکسید آهن برای انتقال ژن در حضور جریان آهن ربایی قوی یا همان magnetofection بهره میبرد.
اکنون که با انواع روشهای انتقال ژن توسط روشهای غیر ویروسی به سلولهای یوکاریوتی آشنا شدیم در بخش دوم به معرفی نکات کلیدی پیرامون بهینه سازی و افزایش کارآیی ترانسفکشن میپردازیم.




3 Comments
روزی خواهد رسید توانایی انسان ها فرا تر از تخیلات امروزمان میرود.
باسلام و وقت بخیر
در فرایند انتقال ژن ایا امکان مشاهده فنوتیپ هست؟ علتش خاصش چیه؟
تشکر از شما
با سلام خدمت شما؛
بعد از انتقال ژن، بسته به اینکه چه نوع ژنی انتقال داده شده است امکان تغییر فنوتیپ وجود خواهد داشت. مثلا چنانچه ژن انتقال یافته به داخل یک سلول تمایز یافته نهایی مانند فیبروبلاست، از ژنهای شبکه پلوریپوتنسی سلولهای بنیادی باشد، overexpress آن ژن منجر به تغییر فنوتیپ سلول فیبروبلاستی به سلول بنیادی خواهد شد.