انتخاب دقیق محیط کشت به منظور کشت سلول های جانوری (بخش اول)
20 اردیبهشت 1399
کشت سلول: چالش pH، دما و CO2
24 اردیبهشت 1399در رابطه با انتخاب دقیق محیط کشت به منظور کشت سلولهای جانوری؛ در بخش اول (انتخاب دقیق محیط کشت به منظور کشت سلولهای جانوری – بخش اول)، در مورد معیارهای انتخاب رده سلولی، منابع تهیه آنها و همچنین خصوصیات سلولهای چسبنده و سوسپانسیونی توضیحاتی ارائه گردید. در این پست خصوصیات انواع متداول محیطهای کشت سلولهای جانوری مورد بحث واقع خواهد شد.
محیط کشت
محیط کشت مناسب، تامین کننده مواد غذایی، فاکتورهای رشد و هورمونها جهت رشد و همچنین دارای فشار اسمزی مناسب و سیستم مناسب تنظیم pH میباشد. اگرچه کشتهای انجام شده در سالیان دور با استفاده از محیط های طبیعی بدست آمده از عصارههای بافتی و مایعات بدن انجام میشد، نیاز به استانداردسازی و افزایش کیفیت محیطهای کشت و به دلیل افزایش تقاضا، محیطهای سنتتیک شیمیایی توسعه یافتند. در حال حاضر سه کلاس اصلی محیط های کشت شامل بر «محیط پایه»، «محیط با سرم کاهش یافته»، و «محیط بدون سرم» میباشند، که در ادامه توضیح داده خواهند شد.
اهمیت سرم در محیطهای کشت
سرم جزء بسیار مهم در کشت سلول بوده و منبعی از فاکتورهای رشد، هورمون ها، لیپیدها و مواد معدنی برای کشت سلول ها در محیط پایه فراهم می کند. همچنین، نفودپذیری غشای سلول را تنظیم کرده و به عنوان حامل لیپیدها، آنزیمها، ریزمغذیها و عناصر کمیاب در سلول عمل می کند. با این وجود، استفاده از سرم در محیط کشت معایبی نظیر هزینه بالا، مشکلات استانداردسازی، اختصاصیت، ایجاد تنوع و همچنین اثرات ناخواسته نظیر تحریک یا مهار رشد سلول را در برخی از کشتهای سلولی خواهد داشت. اگر سرم از منابع معتبر خریداری نشود، آلودگی میتواند تهدید جدی برای کشت سلول نیز به همراه داشته باشد.
مزیت کشت سلول در محیط آزمایشگاهی
یکی از مزیتهای اصلی کشت سلول امکان ایجاد تغییر در عوامل فیزیکوشیمیایی (مثل دما، pH، فشار اسموتیک، فشار اکسیژن و دی اکسید کربن) و عوامل فیزیولوژیکی (نظیر غلظت های مواد غذایی و هورمونها) است طوریکه با کنترل این متغیرها، رشد بهینه یک سلول مشخص ایجاد خواهد شد. به غیر از دما و فشار گازهای مختلف، سایر عوامل ارتباط مستقیم با ترکیبات محیط کشت سلول دارند. از آنجائیکه عوامل فیزیولوژیکی به اندازه عوامل فیزیکوشیمیایی شناخته شده نیستند، با دانستن ترکیبات سرم و ریزمحیط سلول به همراه شناسایی فاکتورهای رشد مورد نیاز برای تکثیر یک سلول مشخص، امکان کشت ردههای سلولی خاص در محیط بدون سرم فراهم خواهد شد.
محیط های کشت پایه
اغلب ردههای سلولی توانایی رشد مناسب در محیطهای پایه (basic culture media) حاوی (آمینواسیدها، ویتامینها، نمکهای غیرآلی و منبع کربن نظیر گلوکز) را دارند، اما افزودن سرم در این محیطها لازم است.
محیط های کشت با سرم کاهش یافته
استراتژی دیگر جهت کاهش اثرات ناخواسته سرم در کشت سلول، استفاده از محیطهایی با سرم کاهش یافته (reduced serum-free culture media) است. این نوع محیطها، از فرمولاسیون محیطهای پایه تبعیت میکنند و علاوه بر آن غنی از مواد غذایی و فاکتورهای مشتق از حیوانات هستند.
محیط های کشت بدون سرم
محیطهای کشت بدون سرم (serum-free culture media) مشکلات مرتبط با سرمهای حیوانی را با جایگزینی سرم با مواد هورمونی و غذایی مرتفع ساختهاند. این نوع محیطها برای اغلب کشتهای اولیه و ردههای سلولی شامل ردههای تولید کننده پروتئین مثل CHO، ردههای سلولی هیبریدوما، سلولهای حشرهای و ردههای سلولی که به عنوان میزبان تولید ویروس هستند در دسترس هستند. یکی از اصلیترین مزیتهای استفاده از این نوع محیطها، توانایی برگزینی محیط منتخب برای انواع سلولهای اختصاصی با ترکیب مناسبی از فاکتورهای رشد میباشد. جدول ذیل مزیتها و معایب محیطهای کشت بدون سرم را در مقایسه با محیطهای کشت حاوی سرم نشان میدهد.
| مزایا | معایب |
|---|---|
| ترکیب مشخص و معین | نیازمند محیط کشت با فرمولاسیون مشخص ویژه یک نوع سلول |
| کنترل دقیق عملکرد سلول | نیازمند درجه خلوص بالا از مواد مختلف |
| اگر در تولید استفاده می شوند، سهولت در تخلیص پروتئین و انجام فرآیندهای پائین دست | ایجاد شرایط رشد آهسته برای بعضی از سلولها |
| فراهم آوردن امکان بررسی دقیق تر عملکردهای سلولی | |
| بهره وری بیشتر | |
| کنترل بهتر بر پاسخ های فیزیولوژیکی | |
| عدم تداخل با شناسایی صحیح میانجی های سلولی مثل مولکولهای پروتئینی پیام رسانی |
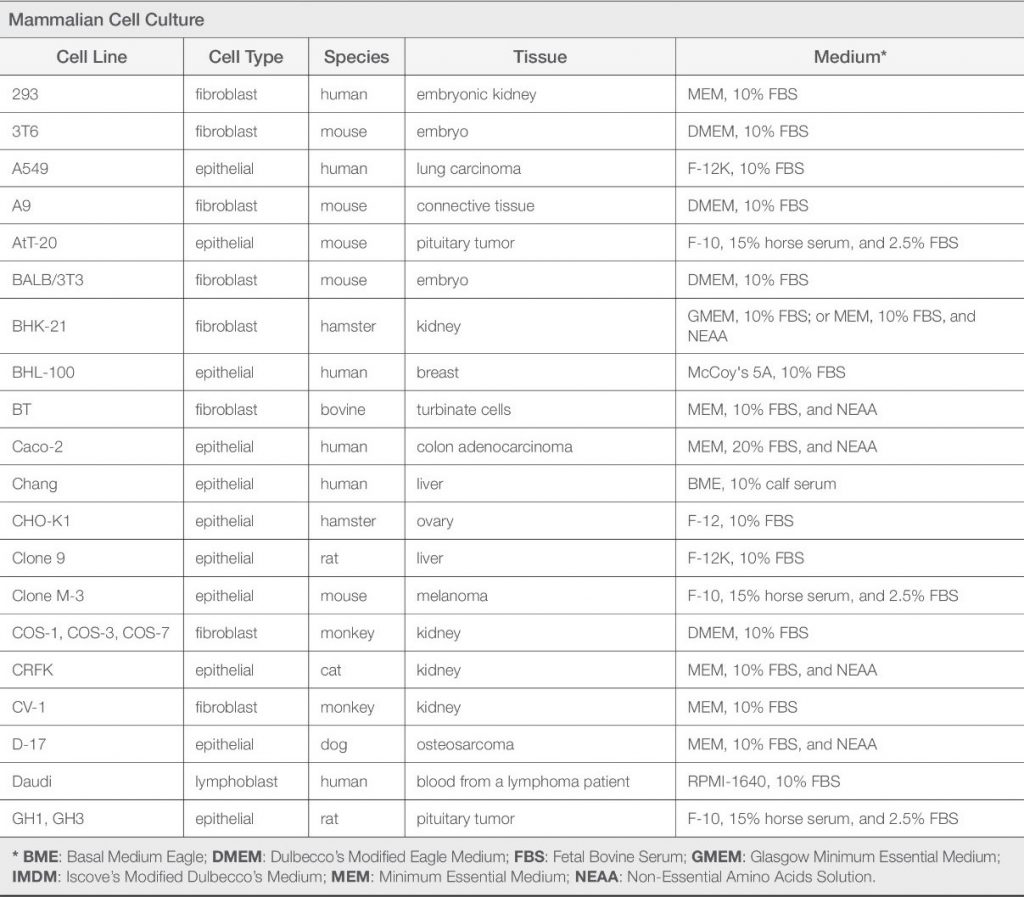
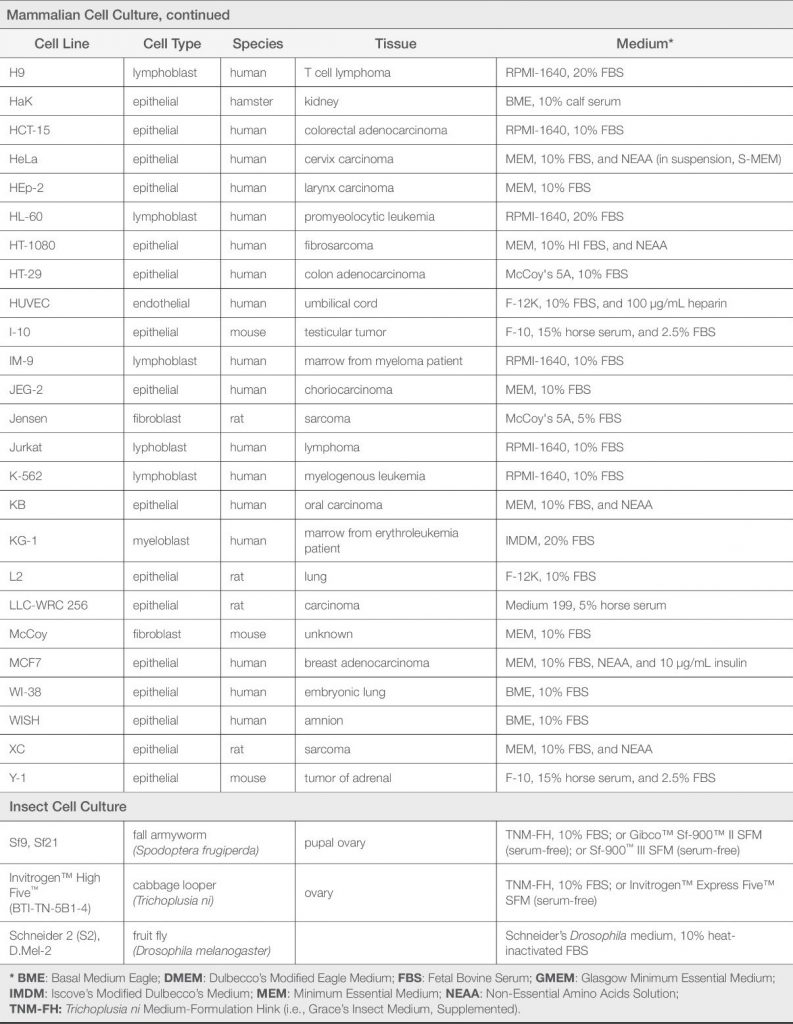
بطور کلی و برای شروع کشت سلول، بهتر است از محیط MEM برای کشت سلولهای چسبنده و از محیط RMPI برای کشت سلولهای سوسپانسیونی استفاده شود. جدول پایین خصوصیات هر یک از محیطهای کشت را نشان میدهد و محققان میتوانند بعد از مقایسه آنها، یک یا چندین مورد را برای انجام کشتهای مورد نظر انتخاب کنند. به صورت یک قاعده کلی (نه همیشگی)، محیط کشتهای α-MEM و DMEM و Ham’s F-12 برای کشت سلولهای چسبنده؛ محیط کشت RPMI برای کشت سلولهای سوسپانسیونی؛ و محیط کشت ترکیبی DMEM/F12 برای کشتهای فاقد سرم استفاده میشود.
| دستهبندی | نام محیط کشت | مشخصات |
|---|---|---|
| Connaught Medical Research Laboratories (CMRL) media | Medium 199 (Morgan et al. 1950) | به منظور کشت سلول های جنین جوجه تحت شرایط عاری از پروتئین طراحی شد. آماده سازی آن به صورت افزودن مرحله به مرحله اسیدهای آمینه، ویتامین ها (محلول در چربی) و پیش سازهای اسید نوکلئیک بوده است. ترکیب آن بسیار پیچیده است چرا که بر اساس مبانی تئوری لازم بود تا ترکیباتی نظیر مواد غیر فعال نیز به این محیط اضافه شود. اغلب برای کشت ارگان استفاده می شود. |
| CMRL1066 (Parker et al. 1957) | Medium 199 بهبود یافته بمنظور کشت سلول های L موشی تحت شرایط عاری از پروتئین می باشد. تغییرات اعمال شده در آن شامل افزایش سطوح مواد احیا کننده (مانند سیستئین، گلوتاتیون و آسکوربیک اسید)، حذف ویتامین های محلول در چربی و تغییر در پیش سازهای اسیدهای نوکلئیک است. | |
| Eagle media | Basal medium Eagle (BME) (Eagle 1955) | یک محیط غنی شده با حداقل ترکیبات مورد نیاز برای کشت سلول های L موشی و سلول های هلا انسانی بمنظور دستیابی به شاخص ظرفیت تکثیری می باشد و شامل 13 آمینواسید و 8 ویتامین است. این محیط به دلیل ترکیب ساده ای که دارد مناسب کشت سلول هایی که نیازمند ترکیبات حداکثری هستند نمی باشد. |
| (MEM) (Eagle 1959) | نوعی BME می باشد که بر اساس نیاز سلول، غلظت اغلب آمینواسیدهای آن دو برابر افزایش یافته است. آمینواسیدهای غیرضروری که سلول ها می توانند آنها را بیوسنتز کنند در فرمولاسیون MEM بکار نرفته است. بنابراین محققان جهت کاهش بار بیوسنتز آمینواسیدهای غیرضروری، می بایست این نوع آمینواسیدها را به محیط MEM اضافه کنند. | |
| Dulbecco’s modified MEM (DMEM) (Dulbecco and Freeman 1959) | نوعی BME می باشد که در آن غلظت آمینواسیدها و ویتامین ها 4 برابر شده است. تا به کنون، تغییرات زیادی در این محیط اعمال شده است طوریکه می توان این محیط را با افزودن آمینواسیدهای غیرضروری، گلایسین و سرین، آهن و پیروات غنی تر کرد. جهت حمایت رشد از سلول هایی با نیازهای تغذیه ای بالا، می توان غلظت گلوکز را تا 25 میلی مول در لیتر افزایش داد. در مواقعی که تغییرات pH به دلیل حضور متابولیت ها است، غلطت سدیم بی کربنات 2 برابر بوده و محیط در انکوباتور حاوی 10 درصد CO2 قرار می گیرد. | |
| α-MEM (Stanners et al. 1971) | نوعی MEM تغییر یافته برای تحقیقات در زمینه کشت رده های سلولی هیبریدی در موش و همستر می باشد. ترکیب آن همان MEM به همراه اسیدهای آمینه غیرضروری، ویتامین ها (آسکوربیک اسید، بیوتین و سیانوکوبالامین)، پیروات، لیپوئیک اسید و نوکلئوزایدها می باشد. | |
| Iscove’s modified DMEM (IMDM) (Iscove and Melchers 1978) | محیط غنی شده با چندین آمینواسید غیرضروری و ویتامین هایی نظیر سیانوکوبالامین و بیوتین که در DMEM وجود ندارد. همچنین حاوی سلنیت، پیروات و HEPES می باشد. ترانسفرین، آلبومین سرم گاوی و لیپیدهای سویا به عنوان جایگزین سرم افزوده شده است. به دلیل غلظت های بالای آمینواسیدها و ویتامین ها، IMDM برای کشت هایی با دانسیته بالا و کشت سلول هایی با پرولیفراسیون بالامناسب است. | |
| Tissue Culture Section of the National Cancer Institute (NCTC) media | NCTC109 (McQuilkin et al. 1957) | این محیط جهت کشت سلول های L تحت شرایط عاری از پروتئین توسعه یافته است و ترکیب آمینواسیدی آن بر پایه ی ترکیبات فرافیلتر شده ی سرم اسب و عصاره بافت جنین جوجه است. ترکیبات آن کاملا پیچیده است و نه تنها شامل کوآنزیم ها، نوکلئوبازها و مواد احیا کننده است بلکه غنی از ویتامین ها نظیر A، C، D، E، K و ویتامین های گروه B می باشد. در ترکیب اصلی آن سیستئین وجود داشت، اما بعد از اینکه مشخص شد تاثیر منفی روی سلول ها دارد در ورژن جدید (NCTC135) سیستئین آن حذف گردید. |
| Ham media | Ham’s F-10 (Ham 1963) | توانایی پشتیبانی از تشکیل کلونی از یک سلول منفرد CHO تحت شرایط عاری از سرم دارد و با اضافه کردن دو نوع پروتئین سرمی تخلیص شده (نظیر آلبومین سرم و فتوئین) به جای سرم و بررسی دقیق نوع وغلظت عناصر کمیاب نظیر مس و روی توسعه یافته است. سلول های CHO ظرفیت تکثیری بالایی در این محیط کشت در عدم حضور منبع سرمی اضافی دارند. علاوه بر این، کشت دیگر رده های سلولی نیازمند اضافه کردن سرم می باشد. |
| Ham’s F-12 (Ham 1965) | جایگزینی آلبومین سرم و فتوئین استفاده شده در Ham’s F-10 با 2 ترکیب شیمیایی مشخص شامل اسید لینولئیک و پوترسین امکان تشکیل یک سلول منفرد CHO را تحت شرایط عاری از پروتئین فراهم می سازند. سطح چندین آمینواسید در این محیط بیشتر از Ham’s F-10 است در حالیکه ویتامین ها (به جز کولین و اینوزیتول) و پتاسیم فسفات در آن کاهش یافته است. بمنظور کشت عاری از پروتئین رده های سلولی دیگر به غیر از CHO، ترکیب آن با کاهش غلظت روی میبایست تغییر کند. بعد از اینکه مشخص شد که عناصر کمیاب موجود در آب یا مواد خام جهت کشت عاری از پروتئین سلول های CHO در Ham’s F-12 لازم هستند، محیط MCBD301 حاوی 20 عنصر کمیاب توسعه یافت. | |
| Kaighn’s modified Ham’s F-12 (Ham’s F-12K) (Kaighn 1974) | بمنظور حمایت از تکثیر و تمایز سلول های کشت اولیه، در این محیط کشت غلظت آمینواسیدها، پیروات، بیوتین، کلسیم، منیزیم، پوترسین و فنول رد در مقایسه با Ham’s F-12 افزایش یافت. | |
| Roswell Park Memorial Institute (RPMI) media | RPMI 1640 (Moore et al. 1966) | این محیط بر پایه محیط McCoy’s 5A (توسعه یافته توسط McCoy et al. 1959) بوده و بمنظور کشت طولانی مدت لنفوسیت های خون محیطی تغییر یافته است. مشخصه آن، سطوح پائین کلسیم و منیزیم و سطوح بالای فسفات است. چندین محیط در مسیر توسعه این محیط معرفی شده است نظیر RPMI 1629، RPMI 1630، و RMPI1634. یکی از محیط های پرکاربرد در کشت های سوسپانسیونی نظیر سلول های خونی، لنفوسیت ها و هیبریدوماها است. همچنین در کشت های مونولایر (سلول های چسبنده تک لایه) نیز کاربرد دارد. |
| Mixed media | DMEM/F-12 (Barnes and Sato 1979) | ترکیبی (۵۰:۵۰) از محیط Ham’s F12 غنی از مواد شیمیایی مشخص و محیط DMEM غنی از مواد غذایی است و مناسب نیازهای انواع مختلفی از سلول ها است. اغلب به عنوان یک محیط پایه برای کشت عاری از سرم استفاده می شود. |
| RPMI 1640/DMEM/F-12 (RDF) (Murakami 1984) | در ابتدا بمنظور کشت عاری از سرم هیبریدوماها توسعه یافته است و ترکیبی از RPMI1640، DMEM و Ham’s F-12 با نسبت 1:1:2 است. معمولا به عنوان محیط عاری از سرم و با افزودن انسولین، ترانسفرین، اتانول آمین و سلنیت استفاده می شود. | |
| Other media | Waymouth’s MB752/1 (Waymouth 1959) | در ابتدا بمنظور کشت سلول های L929 موشی بدون اضافه کردن سرم و سایر پروتئین ها توسعه یافت. این محیط از 40 ترکیب شامل گلوکز، نمک های غیرآلی، آمینواسیدها، ویتامین ها، بازهای پورینی و هایپوگزانتین تشکیل شده است و مشخصه اصلی آن وجود غلظت های بالای گلوکز، هیستیدین، لیزین، گلوتامین، کولین و تیامین است. |
| Trowell’s T-8 (Trowell 1959) | بمنظور کشت طولانی مدت سلول های اپیتلیال کبد موش بالغ طراحی شده است. اگرچه فاقد آمینو اسیدهای غیرضروری و برخی از ویتامین ها است ولی حاوی غلظت های بالای گلوکز و انسولین می باشد. این محیط بمنظور کشت کوتاه مدت ارگان استفاده می شود. | |
| Leibovitz’s L-15 (Leibovitz 1963) | ظرفیت بافری در این محیط کشت به جای بیکربنات سدیم توسط فسفات ها و آمینواسیدهای بازی آزاد تامین می شود. بنابراین pH محیط بدون نیاز به انکوباسیون CO2 تنظیم خواهد شد. بمنظور کنترل کاهش pH که در نتیجه تولید اسید لاکتیک طی متابولیسم گلوکز و آزادشدن CO2 از زنجیره تنفسی است، در ترکیب آن به جای گلوکز از پیروات (و گالاکتوز) استفاده شده است. یکی دیگر از مشخصات اصلی این محیط، آمینواسیدهای تشکیل دهنده آن است که در حدود غلظت حداکثری مربوط به آن اضافه شده است. زمانیکه محققان شروع به استفاده از سیستم بافری HEPES کردند و متوجه شدند که مقادیر مشخصی از بیکربنات سدیم برای تکثییر بهینه سلولی لازم است، محبوبیت این محیط زمانیکه برای انتقال سلول و بافت و همچنین کشت های اولیه استفاده می شد کاهش یافت. | |
| Fischer’s Medium (Fischer and Sartorelli 1964) | این محیط حاوی غلظت بالایی از فولات است چراکه بمنظور استفاده در کشت سلولهای لنفومای L5178Y که وابسته به فولات هستند توسعه یافته است. |
جدول مشخصات انواع متداول محیطهای کشت
منابع
- Thermofischer’s cell culture basics handbook
- ATCC® animal cell culture guide
- Animal-cell culture media: history, characteristics, and current issues (Yao, 2017)