مقدمهای بر انتقال ژن (ترانسفکشن) – بخش اول
26 تیر 1399در بخش ۱ مربوط به پست «انتقال ژن توسط روشهای غیر ویروسی به سلولهای یوکاریوتی» در مورد مواد و روشهای مرسوم ترانسفکشن بحث شد. در بخش ۲ (این مطلب) از این مجموعه سعی داریم تا به معرفی نکات کلیدی پیرامون بهینهسازی و افزایش کارآیی ترانسفکشن بپردازیم. در بخش بعدی (بخش ۳) «نکات فنی مرتبط با پروتکلهای پرکاربرد ترانسفکشن و روشهای ارزیابی کارآیی ترانسفکشن» ارائه خواهد شد.
بخش دوم – ملاحظات عمومی، بهینهسازی و افزایش کارآیی ترانسفکشن
ملاحظات عمومی، بهینهسازی و افزایش کارآیی ترانسفکشن
نیاز است تا شرایط ترانسفکشن مناسب برای رسیدن به یک ترانسفکشن مطلوب بهینهسازی شود. پارامترهای مهمی که باید در نظر داشته باشید عبارتند از انتخاب درست ماده ترانسفکشن، نوع مولکولی که قرار است ترانسفکت شود، نسبت بار ماده ترانسفکشن به میزان اسید نوکلئیک، مدت زمانی که سلول در معرض ماده ترانسفکشن قرار میگیرد، حضور یا عدم حضور سرم، و حضور یا عدم حضور آنتیبیوتیک. بهتر است برای شروع کار از پروتکل استاندارد شرکت سازنده استفاده گردد و در صورت جواب نامطلوب، بهینهسازی تجربی صورت گیرد. پلاسمیدهای حاوی ژن گزارشگر جهت ارزیابی کارآیی ترانسفکشن مورد استفاده قرار میگیرند. بهتر است ارزیابی بیان ژن گزارشگر ۱ تا ۲ روز بعد از ترانسفکشن انجام شود.
انتخاب ماده ترانسفکشن
ماده ترانسفکشنی وجود ندارد که توانایی انتقال ژن به تمامی سلولها را داشته باشد و هر یک از آنها بسته به نوع سلول و شرایط آزمایش نیازمند بهینهسازی میباشند. با وجود روشهای بسیار مختلف جهت انتقال ژن، چگونه میتوان ماده ترانسفکشن و روش انتقال ژن مناسب را انتخاب کرد؟ اگرچه روشهای شیمیایی قدیمی هنوز هم برای انتقال ژن استفاده میشود، ترکیبات بر پایه لیپیدی به دلیل سهولت در استفاده و کاربرد آنها بر روی طیف وسیعی از سلولها از محبوبیت ویژه ای برخوردار هستند. لیپوفکتامین (ساخت شرکت Thermo Fisher) و مشتقات جدیدتر آن بطور گسترده برای انجام آزمایشات بیانی گذرا و پایدار استفاده میشوند. FuGENE® HD (ساخت شرکت Promega) نیز به دلیل سهولت در استفاده و سازگاری با طیف وسیعی از سلولها مورد توجه محققان میباشد.
هر زمانی که یک پارامتر جدید نظیر یک ردهی سلولی جدید داشتید نیاز است تا شرایط بهینه را برای ترانسفکشن تعیین کنید. این فرآیند شاید نیاز به انتخاب یک ماده ی ترانسفکشن جدید داشته باشد. برای مثال، یک ماده ی ترانسفکشن با سلولهای HEK-293 به خوبی سازگار است اما ماده ی دیگر ممکن است انتخاب مناسب برای استفاده در سلولهای HepG2 باشد. برخی از کمپانی ها نظیر پرومگا پایگاه اطلاعاتی مربوط به پروتکل های مورد استفاده برای ترانسفکت یک سلول مشخص با یک ماده ی ترانسفکت مشخص مثل FuGENE® HD را فراهم کرده اند (FuGENE® HD Protocol Database). این پایگاه اطلاعاتی، منویی را در اختیار کاربر قرار میدهد تا با وارد کردن نوع رده سلولی، نوع ظرف کشت، و تعداد سلولهایی که قرار است ترانسفکت شود، پروتکل عملی مربوط به ترانسفکت آن سلول با FuGENE در دسترس قرار میگیرد. البته توجه داشته باشید که این یک راهنما بوده و در صورتی که به طرز مطلوب جواب ندهد نیاز است تا شرایط ترانسفکشن توسط کاربر بهینه گردد. برای اطلاعات بیشتر به بخش های بهینهسازی کارآیی ترانسفکشن و پروتکلهای عمومی ترانسفکشن مراجعه فرمائید.
نوع مولکول ترانسفکت شده
DNA پلاسمیدی مرسومترین نوع مولکول ترانسفکت شده به سلولها است، اما سایر ماکرومولکول ها نیز قابلیت ترانسفکت دارند. به عنوان مثال، DNA الیگونوکلئوتیدی، RNA های مداخله گر کوچک (siRNA)، پروتئینها و کمپلکسهای ریبونوکلئوپروتئینی (RNP) نیز بطور موفقیتآمیزی به سلولها انتقال داده میشوند. با این وجود، شرایطی که برای انتقال DNA پلاسمیدی استفاده میشود، نیازمند بهینهسازی است تا بتوان سایر ماکرومولکولها را هم انتقال داد. در همه موارد، مولکولی که کاندید ترانسفکت است میبایست از کیفیت و خلوص بالایی برخوردار باشد. اسیدهای نوکلئیک باید عاری از پروتئین، و سایر اسیدهای نوکلئیک آلودهکننده و مواد شیمیایی نظیر نمک باشند. اگر مولکولی که قرار است ترانسفکت شود، پروتئینی باشد میبایست خالص بوده و در محلولی باشد که به سلول آسیب نرساند.
بطور کلی و بسته به هدف آزمایش، ترانسفکشن با یک مولکول خاص مثل یک پلاسمید بیانی به دو منظور انجام میشود:
۱- بیان گذرا
در مطالعات طراحی شده بمنظور آنالیز بیان گذرای ژنها، سلولها بطور معمول ۲۴ تا ۷۲ ساعت بعد از ترانسفکشن جمعآوری (هاروست / harvest) میشوند. این فاصله زمانی وابسته به نوع سلول، اهداف تحقیق و خصوصیات بیانی اختصاصی ژن ترانسفکت شده است. مثلا، بیان ژن لوسیفراز کرم شب تاب در وکتور pGL4 بطور معمول ۲۴ تا ۴۸ ساعت بعد از ترانسفکشن ارزیابی میشود، در حالیکه وکتور pGL4.12 با توالیهای تخریب کننده پروتئینی در زمان کوتاه تری ارزیابی خواهد شد (۳ تا ۱۲ ساعت).
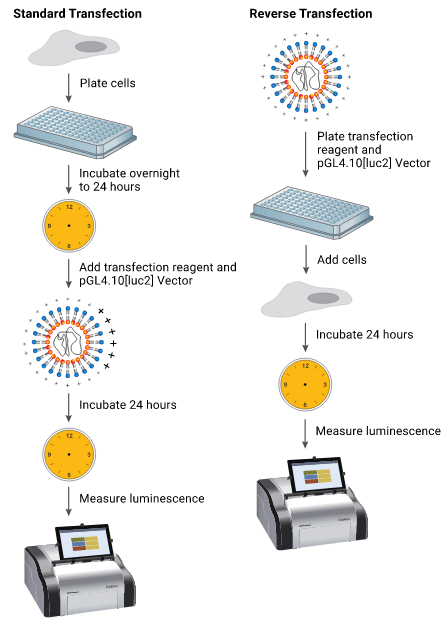
زمانی که در حال انجام ترانسفکشن گذرا هستید، شما میتوانید یک پروتکل ترانسفکشن استاندارد یا یک پروتکل ترانسفکشن معکوس را طبق شکل ۱ انتخاب کنید. در یک پروتکل استاندارد؛ سلولها:
- در روز ۱ کشت داده شده،
- در روز ۲ ترانسفکت شده و
- در روز 3 یا 4 ارزیابی میشوند.
در پروتکل ترانسفکشن معکوس، سلولها مستقیما بر روی ظرف حاوی پلیپلکس ریخته شده و در روز ۲ یا ۳ مورد ارزیابی قرار میگیرند. به دلیل اینک سلولها بطور مستقیم روی کمپلکس ترانسفکشن اضافه میشوند، این پروسه زمان آزمایش را یک روز کاهش داده و امکان ترانسفکشن با کارایی بالا را فراهم میسازد.
۲- بیان پایدار
ترانسفکشن پایدار منجر به الحاق ژن ترانسفکت شده به ژنوم سلول میشود. الحاق ژن خارجی در ژنوم امکان مطالعه تاثیرات بلند مدت بیان یک ژن یا ایجاد ردههای سلولی با خصوصیات جدید، و همچنین امکان غربالگری یک داروی بالقوه در آزمایش های ارزیابی دارو را فراهم میسازد.
هدف از ترانسفکشن پایدار و طولانی مدت، جداسازی و تکثیر کلون های منحصر بفرد حاوی DNA ترانسفکت شده است که در ژنوم سلولی الحاق شده است. تشخیص سلولهای ترانسفکت نشده از سلولهای ترانسفکت شده مستلزم غربالگری انتخابی است. مثلا در صورتیکه از ژن مقاومت به آنتیبیوتیک در کنار ژن خارجی استفاده شود، غربالگری توسط یک آنتیبیوتیک اختصاصی امکانپذیر خواهد بود. در برخی موارد، تغییرات مورفولوژیکی میتواند به عنوان یک خصوصیت انتخابی باشد. مثلا، وکتورهای ویروسی پاپیلومای گاوی منجر به تغییر مورفولوژیکی در سلولهای کشت یافته CL127 موشی خواهند شد.
قبل از استفاده از یک دارو یا آنتیبیوتیک اختصاصی برای اهداف غربالگری، نیاز است تا میزان مورد نیاز آن دارو جهت از بین بردن سلولهای ترانسفکت نشده تعیین شود. این مورد ممکن است در میان انواع سلولها متفاوت بوده و برای هر رده سلولی جدیدی که قرار است ترانسفکت شود بهینه گردد.
زمانیکه انتخاب دارویی/آنتیبیوتیکی استفاده میشود، سلولها در یک محیط غیرانتخابی (محیط کشت بدون دارو/آنتیبیوتیک) به مدت ۱ تا ۲ روز بعد از ترانسفکشن کشت مییابند و سپس در معرض محیط انتخابی (محیط کشت با دارو/آنتیبیوتیک) قرار میگیرند. استفاده از محیط انتخابی به مدت ۲ روز تا ۳ هفته بسته به نوع دارو/آنتیبیوتیک ادامه مییابد و در این مدت بطور منظم محیط کشت انتخابی تعویض میشود تا سلولهای مرده و بقایای سلولی حذف شده و در نهایت کلونیهای مشخص قابل مشاهده گردند. کلونیهای منحصربفرد میتوانند توسط سیلندرهای کلونینگ جداسازی شده، انتخاب شده و به چاهکهای کشت کوچکتر بمنظور تکثیر بیشتر در حضور محیط انتخابی انتقال داده شوند. از سلولهای منحصربفردی که زنده ماندهاند کلونگیری شده و این کلونها بمنظور بررسی های بیشتر تکثیر مییابند.
چندین مارکر انتخابی متفاوت به صورت معمول برای مطالعات ترانسفکشن طولانی مدت استفاده میشوند. مثلا، سلولهای ترانسفکت شده با وکتورهای نوترکیب حاوی ژن باکتریایی نئومایسین فسفوترانسفراز میتواند در حضور G418 (آنالوگی از نئومایسین) غربال شوند. بطور مشابه، بیان ژن هیگرومایسین B فسفوترانسفراز منجر به مقاومت سلولهای حاوی این ژن در برابر آنتیبیوتیک هیگرومایسین خواهد شد.
استراتژی جایگزین، استفاده از وکتور حامل ژنی است که آن ژن در رده سلولی ترانسفکت شده معیوب شده است. مثلا، سلولهای CHO با فقدان بیان ژن DHFR در عدم حضور نوکلئوزیدها بقا نخواهند داشت. با این وجود، این سلولها، زمانیکه با وکتور بیان کننده ی ژن DHFR ترانسفکت شدند، نوکلئوزیدهای مورد نیاز را سنتز کرده و بقا خواهند داشت.
نسبت بار ماده ترانسفکشن کاتیونی به DNA
میزان شارژ مثبت ارائه شده توسط ترکیب کاتیونی-لیپیدی ماده ترانسفکشن باید برابر یا بیشتر از میزان بار منفی ارائه شده توسط فسفات های DNA باشد تا اینکه میزان شارژ خالص بر روی وزیکولهای مولتی لامینار خنثی یا مثبت باشد. اگر چنانچه محیط حاوی سرم است، بهنیه سازی نسبت DNA به لیپید مهم خواهد بود.
میزان بهینه DNA با توجه به نوع اسید نوکلئیک، تعداد سلولها، اندازه ظرف کشت و رده سلولی استفاده شده متفاوت خواهد بود. مثلا، سلولهای COS-7 بطور بهینه با 100 نانوگرم پلاسمید pGL4.13 و با استفاده از ماده ViaFect™ با نسبت ۴ به ۱ از ماده ترانسفکت به DNA در یک ظرف ۹۶ خانه ترانسفکت میشود. در مقابل، همان سلولها با ۵۰ نانوگرم DNA و با استفاده از ماده FuGENE® HD با نسبت ۳ به ۱ از ماده ترانسفکت به DNA در یک ظرف ۹۶ خانه ترانسفکت میشوند.
افزایش میزان DNA ترانسفکت شده ممکن است نتیجه معنی دار مطلوبی به دنبال نداشته باشد. در حقیقت، اگر نتایج اولیه ترانسفکشن رضایت بخش هستند، میزان کم DNA میتواند تست شود (البته با حفظ نسبت ثابت reagent:DNA). اغلب یک محدوده از غلظت های DNA برای ترانسفکشن مناسب است. با این وجود، اگر غلظت DNA از این محدوده بالاتر یا پائین تر باشد، کارایی آن کاهش خواهد یافت. اگر میزان DNA بسیار کم باشد، جواب آزمایش مطلوب نخواهد بود و اگر بسیار زیاد باشد، منجر به ایجاد سمیت در سلولها خواهد شد.
زمان در ترانسفکشن
مواد ترانسفکشن بایستی به طور مرسوم در یک دوره زمانی مشخص در مجاورت سلولها بمانند. بعد از آن، محیط تازه اضافه شده یا محیط قبلی تعویض میشود تا از اثرات سمی ماده ترانسفکشن ممانعت بعمل آید. دوره زمانی بهینه ترانسفکشن وابسته به رده سلولی، ماده ترانسفکشن و DNA استفاده شده است. برای برخی از مواد ترانسفکشن همانند ViaFect™ نیازی به تعویض محیط نخواهد بود (برای سایر مواد ترانسفکشن به دستورالعمل شرکت سازنده مراجعه کنید یا میتوانید به صورت تجربی تست کنید).
برای شروع کار با مواد لیپوزومی که نیازمند اضافه کردن یا تعویض محیط کشت میباشند، به طور مثال میتوان ۶ کشت مشابه انجام داده و در یک ساعت مشخص ترانسفکشن را انجام داد؛ سپس با فواصل یک ساعت محیطها به ترتیب تعویض میشوند (معمولا ترانسفکشن میتواند در زمانی بین ۳۰ دقیقه تا ۶ ساعت یا حتی یک شبانه روز بسته به ماده ترانسفکشن استفاده شده انجام شود). مورفولوژی سلول را طی انجام واکنش ترانسفکشن با فواصل زمانی مناسب ارزیابی کنید، مخصوصا زمانی که که ترانسفکشن در محیط کشت فاقد سرم در حال انجام است، چراکه برخی از سلولها تحت شرایط ترانسفکشن آسیب پذیر میباشند.
سرم
پروتکل های ترانسفکشن اغلب از شرایط بدون سرم برای عملکرد بهینه استفاده میکنند، زیرا سرم میتواند با اغلب مواد ترانسفکشن تجاری در دسترس تداخل ایجاد کند. برخی از این مواد مشکلی با حضور سرم ندارند که این مواد میتوانند برای ترانسفکت انواع سلولها بویژه سلولهای اولیه یا مواردی که نیاز است تا سرم بطور مداوم در کشت حضور داشته باشد بسیار مناسب باشند.
آنتیبیوتیک
حضور آنتیبیوتیکها طی ترانسفکشن ممکن است بطور نامطلوبی کارآیی ترانسفکشن و حتی سلامت سلولهای ترانسفکت شده را تحت تاثیر قرار دهد. استفاده از محیط حاوی آنتیبیوتیک در زمان ترانسفکشن و بعد از ترانسفکشن (تا ۲۴ ساعت بعد از ترانسفکشن) توصیه نمیشود مگر اینکه تاثیرات آن قبلا چک شده باشد.